近日,國家食品藥品監督管理總局發佈《2015年度藥品檢查報告》,公佈了2015年藥品生産品質管理規範(簡稱藥品GMP)認證檢查、GMP跟蹤檢查、飛行檢查等7項檢查情況,共計檢查企業698家次。其中,藥品GMP認證檢查數量較前兩年有所降低,但藥品生産企業的整改率同比提高近一倍。業內專家紛紛表示,藥品生産品質監管力度明顯加強,一批小、散、亂的藥品生産企業逐漸被淘汰,行業整合升級跡象顯現。
新版GMP成效明顯
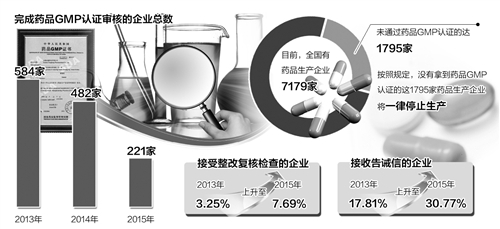
報告顯示,2015年國家食品藥品監督管理總局食品藥品審核查驗中心共接收藥品GMP認證申報資料221份。其中,完成審核的企業總數由2013年的584家、2014年的482家降至2015年的221家,創下近3年的新低。
“去年完成審核的藥品生産企業數量同比下降幅度之所以大,與新版藥品GMP認證有密切聯繫。”國家食藥監總局相關負責人介紹説,根據規定,國家食藥監總局2011年3月啟動了新版藥品GMP認證,並要求血液製品、疫苗、注射劑等無菌藥品的生産,應在2013年12月31日前達到新版藥品GMP要求;其他類別藥品的生産均應在2015年12月31日前達到新版藥品GMP要求。未通過新版藥品GMP認證的企業、生産車間一律停止生産。
在2015年藥品GMP認證檢查中,共安排檢查224家次,其中212家藥品生産企業通過檢查,9家企業未通過。報告顯示,對無菌藥品生産風險控制不足、數據可靠性問題、品質管理體系無法保證産品的生産和品質要求等是9家企業未能通過檢查的主要因素。
與舊版GMP相比,新版藥品GMP認證更接近國際標準,對企業的生産設備和管理水準要求也更高。尤其是對生産環境、設備設施、文件管理、風險控制等一系列流程提出了明確要求,為政府部門監管和保障藥品品質安全提供了著力點。
藥品監管日趨嚴格
報告顯示,藥品GMP認證檢查數量較前兩年有所降低,但接受整改復核檢查和接收告誡信的企業所佔比例明顯上升,前者由2013年的3.25%上升至2015年的7.69%,後者則由2013年的17.81%上升至2015年的30.77%。
與此同時,《2015年全國收回藥品GMP證書情況統計》顯示,2015年全國共有140家藥企的144張GMP證書被收回。國家食藥監總局公佈的數據顯示,目前,全國有藥品生産企業7179家,未通過藥品GMP認證的達1795家。按照規定,沒有拿到“準生證”的這1795家藥品生産企業將一律停止生産。
“新版藥品GMP認證實施後,一定程度上促進了醫藥行業重新洗牌。”中國醫藥保健品進出口商會副會長劉張林認為,標準嚴格的認證給藥企經營環境帶來了更大的考驗,有實力的大藥企紛紛出招力保拿到“準生證”。
不過,通過藥品GMP認證並非意味著可以“一勞永逸”。隨著今年藥品GMP認證下放到省級食藥監局,省級GMP認證檢查任務進一步加大,藥企也開始面臨更多的飛行檢查、跟蹤檢查、抽查檢查等運動式檢查,監管力度也進一步加強。據不完全統計,截至5月底,通過飛行檢查,全國已有52家藥企被收回GMP認證證書。
前不久,國家食藥監總局食品藥品審核查驗中心又公佈了2016年藥品首批GMP跟蹤檢查的216家企業名單,多個省區市也公佈了2016年GMP飛行檢查方案和工作重點。“216家企業的名單數量比去年增加了20%的跟蹤檢查企業數量,而這個數字在2017年很有可能會繼續增加,飛行檢查的力度還會增強。”天津市市場和品質監督管理委員會認證中心工作人員王守斌表示,今後,飛行檢查的力度和嚴格程度必定會再上一個臺階。
行業將迎整合大潮
目前,嚴格的飛行檢查已經成為藥品的常態監管措施。在飛行檢查常態化、嚴格化之後,未通過認證、被直接淘汰的藥企數量也隨之增加。
“很多未通過藥品GMP認證的企業都是小企業,因為無法負擔成本而放棄GMP認證,部分中藥生産企業直接轉做保健品市場,而很多靠生産批號過日子的小企業直接選擇退出市場。”北京鼎臣醫藥管理諮詢中心負責人史立臣認為,對於那些擁有多個有價值的藥品批文的企業,即使沒有通過新版GMP認證,未來也可以與通過認證、實力雄厚的企業並購整合,實現共贏。而對於已經順利拿到藥品GMP認證證書的藥企,規範生産、提高藥品品質才是根本。
值得注意的是,産能過剩、成本上升等問題始終制約著我國醫藥行業的發展。當前,我國藥品生産企業整體上小、散、亂的格局尚未根本改變,市場上藥品同質化現象比較嚴重,由此造成的生産經營不規範、低水準重復和過度競爭是引發藥品品質安全事件的主要原因。
對此,業內專家認為,從行業發展需要來看,新版藥品GMP認證能“倒逼”藥品生産企業規範産品、提升品質,淘汰落後企業,為行業龍頭和上市企業提供更多整合升級的機會。未來,國內藥企也不能再依靠低價格低成本競爭,而要在合規的基礎上提高藥品品質,提升企業競爭力。總之,隨著新版藥品GMP認證加速推進以及各項政策措施協調配合,我國藥品品質安全保障能力將進一步提升。
(責任編輯:金瀟)











