2015版藥典的立項啟示
- 發佈時間:2015-10-09 09:50:50 來源:東方網 責任編輯:吳起龍
由CFDA批准頒布的2015年版《中華人民共和國藥典》(簡稱“2015年版藥典”),將於2015年12月1日起正式實施。
2015年版藥典重點加強了對藥品安全性和有效性的控制要求。藥典收錄的品質控制技術,可以反映我國當前醫藥發展和檢測技術的現狀,並將推動我國藥品品質提高,加快企業技術進步和産品升級換代。
藥典主要是針對已上市藥品的品質標準,因而對已上市藥物影響更大。對於研發立項而言,從藥典中可以窺探藥典委員會對現有藥物的一些態度,從而推斷項目的可行性。對市場準入而言,藥典的行政意義就更大了,雖然藥典的品質標準是最低的準入標準,但個別省份的招標政策會允許藥典起草單位獲得優勢。最近湖北的招標方案甚至將藥典産品和非藥典産品分組。
四部“改劑型”?
定義更科學,更關注臨床用量大的劑型,新劑型走向存疑。
2015年版藥典比2010年版的三部多了一部,變成四部。第四部其實是在對各部藥典共性附錄進行整合,將原附錄更名為通則,重新建立規範的編碼體系後將通則、藥用輔料單獨作為中國藥典第四部。第四部收載通則總計317個,其中製劑通則38個、檢驗方法240個、指導原則30個、標準物質和試液試藥相關通則9個。
第四部的製劑通基本涵括了2010年版三部藥典的附錄製劑通則,如表1所示,在定義上更是涵括了2010年三部藥典附錄。
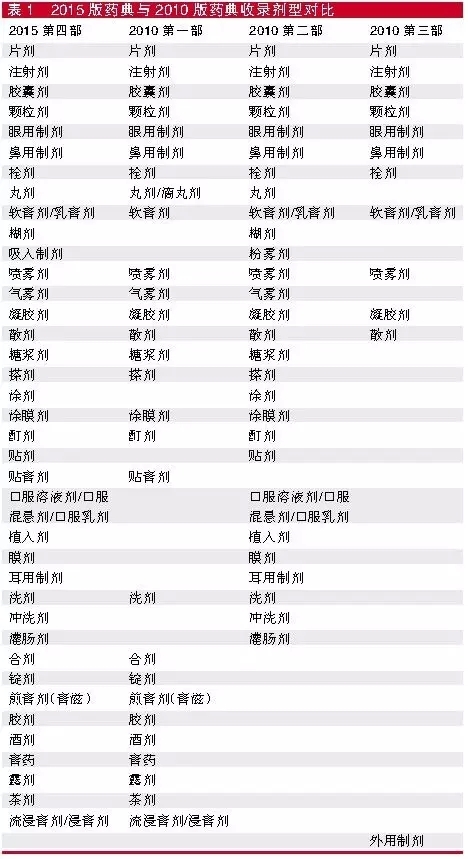
以片劑為例,2010年第一部的附錄定義為“片劑係指提取物、提取物加飲片細粉或飲片細粉與適宜輔料混勻壓制或用其他適宜方法製成的圓片狀或異形片狀的製劑”;第二部的定義則是“片劑係指藥物與適宜的輔料混勻壓制而成的圓片狀或異形片狀的固體製劑”;第三部的定義為“片劑係指以生物製品原液經乾燥後製成的乾粉為原料藥物,與適宜的輔料混勻壓制而成的圓片狀或異形片狀的固體製劑;該原料藥可由一種或多種活性成分組成”。2015年第四部的定義是“片劑係指原料藥物或與適宜的輔料製成的圓形或異形的片狀固體製劑”。
此定義以“原料藥物”精煉了中藥的“提取物、提取物加飲片細粉或飲片細粉”和生物藥的“生物製品原液經乾燥後製成的乾粉為原料藥物,該原料藥可由一種或多種活性成分組成”,並且“或與適宜的輔料”將範圍涵括了部分直接原料藥製片的産品,取消了“混勻壓制而成”的字眼則與時俱進地將片劑工藝限制放開。
事實上,對於改劑型,各職能部門的態度有所不同。CFDA曾表明,對盲目為新藥證書或者招標獨家劑型而更改劑型行為持限制態度;8月18日發佈的《國務院關於改革藥品醫療器械審評審批制度的意見》,對具備創新性和臨床意義的産品持正向態度的;各地招標辦則經常將藥典的劑型分類作為招標分組的參考。
第四部將注射劑分為“注射液、注射用無菌粉末與注射用濃溶液等”。其中注射液係指“原料藥物或與適宜的輔料製成的供注入體內的無菌液體製劑,包括溶液型、乳狀液型或混懸型等注射液”,注射用無菌粉末係指“原料藥物或與適宜輔料製成的拱臨用前無菌溶液配成注射液的無菌粉末或無菌塊狀物,一般採用無菌分裝或冷凍乾燥法制得。以冷凍乾燥法製備的生物製品注射用無菌粉末,也可稱為注射用凍幹製劑”,注射用濃溶液係指“原料藥物與適宜輔料製成的供臨用前稀釋後靜脈滴注用的無菌濃溶液”。
以上定義都沒有提及目前市場上企業關注的注射劑熱點,如注射用幹乳劑、脂質體、微球、奈米膠束等,而這些劑型對應的我國上市批文基本都沒有超過10個。這些熱點注射劑型沒有單獨細分出來,或許還是與藥典更關注臨床常用劑型有關。
相較之下,2010年已經上藥典的緩釋片、控釋片和腸溶片順理成章地進入2015年版藥典,此類藥品在2010年之後的招標中經常單列。
注射用幹乳劑、脂質體和微球能否在未來招標中劑型單列存疑。此外,注射用濃溶液目前只有諾華的注射用唑來膦酸濃溶液1個批文,在符合臨床需求的應用下,注射用濃溶液的研發或許是個方向。
新技術促産業淘汰?
藥典委員會的態度是:非常慎重而不冒進,充分考慮國情的同時逐步推動産業升級
本版藥典在保留以往常規檢測方法的基礎上,進一步擴大了對新技術、新方法的應用,提高了檢測的靈敏度、專屬性和穩定性。
藥典新收錄了液相色譜法-串聯質譜法、分子生物學檢測技術、高效液相色譜-電感耦合電漿體質譜法等用於中藥的品質控制,採用超臨界流體色譜法、臨界點色譜法、粉末X射線衍射法等用於化藥的品質控制,採用毛細管電泳分析測定重組單克隆抗體産品分子大小異構體,採用高效液相色譜法測定抗毒素抗血清製品分子大小分佈等。
在檢測技術儲備方面,建立了中藥材DNA條碼分子鑒定法、色素測定法、中藥中真菌毒素測定法、近紅外分光光度法、基於基因晶片的藥物評價技術等指導方法。
值得注意的是,第一部藥典新收錄的質譜法,更多是用在藥材的重金屬檢測上,製劑實際應用的很少,只有2個産品收錄且是應用於重金屬檢測;而本部藥典中藥測定方法收錄了76種氣相色譜-串聯質譜法和155種農藥的液相色譜-串聯質譜法。這宣示國家對中藥種植中農藥殘留過多問題處理的決心,也意味著未來中藥材成本會越來越高。
相對中藥而言,化藥對成分的控制更直接明確。以肝素鈉為例,2010年的標準為“每1mg的效價不得少於170單位”,2015年藥典則為“以乾燥品計算,每1mg抗Ⅱa因子的效價不得少於180IU,抗Xa因子效價與抗Ⅱa因子的效價比應為0.9~1.11”,鑒別和對應的手段提高。
坊間有個説法,通過藥典品質標準檢查方法的提升,可逃避藥品生産工藝的提升,同時可將競爭對手淘汰。譬如當年高效液相儀器的提升就是一次行業升級淘汰。畢竟藥典的關注點更多是藥品成分含量測定,對藥品工藝製造方法的限制有限,更沒有評判藥品臨床有效性的職責。
此前傳聞,肝素類藥物有可能參照美國新藥典核磁共振法的標準,但本次藥典最終選擇美國舊藥典分子排阻色譜法,核磁共振法的儀器成本非常高,國內企業和檢驗機構未必能立即負擔。
可見,藥典委員會對品質標準提升的態度是:非常慎重而不冒進,充分考慮國情的同時逐步推動産業升級。
收錄新産品?
化藥收錄重點是臨床需求大的産品;生物藥支援國産自主創新藥,淘汰舊産品
2015年版藥典一部收載藥材和飲片、植物油脂和提取物、成方製劑和單味製劑等,共計2598種。其中新增440種,修訂517種,不收載7種;含“兒”字産品新增13品種,不收載1種。
二部收載化學藥品、抗生素、生化藥品以及放射性藥品等,品種共計2603種,其中新增492種,修訂415種,不收載28種。
許多指南用藥和銷售量較大的藥品被新增,如本次新增了艾司奧美拉唑鈉(曾用名:埃索美拉唑)、蘭索拉唑和奧美拉唾鈉的原料藥、針劑和腸溶片,泮托拉唑鈉腸溶膠囊,雷貝拉唑鈉、雷貝拉唑鈉腸溶片和雷貝拉唑鈉腸溶膠囊等,基本將目前常用的PPI産品都涵括了。這體現本次藥典收錄産品,除了保證國家基本藥物目錄品種全覆蓋外,臨床需求大的産品也是收錄重點。
三部收載生物製品137種,其中新增13種,修訂105種,不收載6種。
最值得關注的是注射用鼠神經生長因子和尼妥珠單抗注射液,二者被新增入治療類目錄。鼠神經生長因子符合國家對多組分生化藥升級的方向,提取純化等步驟都有嚴格控制標準。尼妥珠單抗由百泰生物藥業研製,適應症為與放療聯合治療表皮生長因子受體(EGFR)表達陽性的Ⅲ/Ⅳ期鼻咽癌。另一方面,注射用抗人T細胞CD3鼠單抗未被收載。
輔料進入2015年版藥典第四部是一個進步,雖然收錄的270種藥用輔料(其中新增137種、修訂97種、不收載2種)還不能滿足目前的生産需求,但這意味著,對於我國製劑行業而言,規範輔料勢在必行。
- 股票名稱 最新價 漲跌幅








