據國家藥監局網站消息,經河南省食品藥品檢驗所等9家藥品檢驗機構檢驗,標示為江蘇吳中醫藥集團有限公司蘇州制藥廠等14家藥品生産企業生産的25批次藥品不符合規定。現將相關情況通告如下:

一、經河南省食品藥品檢驗所檢驗,標示為江蘇吳中醫藥集團有限公司蘇州制藥廠生産的9批次注射用硫酸阿米卡星不符合規定,不符合規定項目為溶液的澄清度與顏色。
經廣西壯族自治區食品藥品檢驗所檢驗,標示為安徽國正藥業股份有限公司生産的1批次復方愈創木酚磺酸鉀口服溶液不符合規定,不符合規定項目為裝量。
經江蘇省食品藥品監督檢驗研究院檢驗,標示為湖南華納大藥廠股份有限公司生産的1批次蘭索拉唑腸溶片不符合規定,不符合規定項目為溶出度。
經上海市食品藥品檢驗所檢驗,標示為海南通用康力制藥有限公司生産的4批次注射用奧扎格雷鈉不符合規定,不符合規定項目為可見異物。
經湖北省藥品監督檢驗研究院檢驗,標示為長春人民藥業集團有限公司生産的1批次嬰兒健脾散不符合規定,不符合規定項目為粒度。
經四川省食品藥品檢驗檢測院檢驗,標示為江西鴻爍制藥有限責任公司生産的1批次元胡止痛片不符合規定,不符合規定項目為含量測定;標示為天津同仁堂集團股份有限公司、廣東省惠州市中藥廠有限公司生産的2批次元胡止痛片檢出金胺O。
經中國食品藥品檢定研究院檢驗,標示為河北濟鑫堂藥業有限公司生産的1批次廣藿香不符合規定,不符合規定項目為性狀。
經安徽省食品藥品檢驗研究院檢驗,標示為重慶三立堂中藥制藥有限公司、成都吉安康藥業有限公司、內江良輝藥業有限公司生産的3批次黃精不符合規定,不符合規定項目為性狀。
經大連市藥品檢驗檢測院檢驗,標示為新疆本草堂藥業有限公司生産的1批次前胡不符合規定,不符合規定項目為性狀。
經中國食品藥品檢定研究院檢驗,標示為成都市祺隆中藥飲片有限公司生産的1批次制川烏不符合規定,不符合規定項目為性狀。
二、對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位採取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查並切實進行整改。
三、國家藥品監督管理局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位生産銷售假劣藥品的違法行為立案調查,並按規定公開查處結果。
天眼查資訊顯示,江蘇吳中醫藥集團有限公司是A股上市公司江蘇吳中實業股份有限公司(簡稱:江蘇吳中 代碼:600200)的核心控股子公司,是國家火炬計劃吳中醫藥産業基地的龍頭骨幹企業。集團主要從事生物藥、化學藥、現代中藥的研發、生産、銷售。集團是蘇州市醫藥行業協會會長單位,設有省級企業技術中心,並擁有江蘇省唯一的基因藥物工程技術中心,成立了博士後科研工作站。集團共有全資和控股企業9家,形成集研發、生産、銷售為一體的完整的醫藥産業鏈。

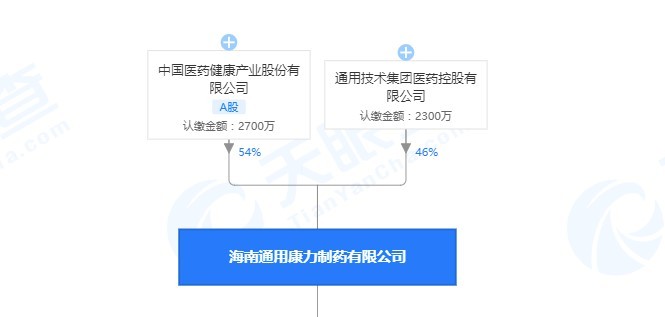
海南通用康力制藥有限公司專注于高品質注射劑類(凍乾粉針劑、無菌粉針劑、小容量水針劑)産品的研發、生産和銷售,經過多年的持續積累和創新,現有文號111個,覆蓋10多個領域,産品聚焦心腦血管類、全身性抗感染類、能量合劑類,抗腫瘤類四大治療領域。其中A股上市公司中國醫藥健康産業股份有限公司(簡稱:中國醫藥 代碼:600056)持股54%。
湖南華納大藥廠股份有限公司為科創板IPO受理的公司,簡稱華納藥廠。2001年4月30日,瀏陽市華納大藥廠有限公司成立。 2003年1月17日,公司更名為湖南華納大藥廠有限公司。 2015年11月6日,公司整體變更設立股份有限公司,名稱變更為湖南華納大藥廠股份有限公司。
公司曾于2016年計劃創業板IPO未果,此次轉戰科創板,擬發行不超過2350萬股,募資13.82億元,用於藥物研發項目、年産1000噸高端原料藥物生産基地建設一二期續建項目等。公司主營化學原料藥、化學藥製劑和中藥製劑的研發、生産與銷售,具備片劑、膠囊、顆粒、散劑、幹混懸劑、吸入溶液劑、小容量注射劑、滴眼劑、凍乾粉針劑等多種劑型和化學原料藥的生産能力。
(責任編輯:朱赫)
