中國網財經7月24日訊(記者 牛荷) 昨日,國家藥監局發佈的“關於25批次藥品不符合規定的通告(2020年第50號)”顯示,江蘇吳中醫藥集團有限公司蘇州制藥廠(“江蘇吳中蘇州制藥廠”)等14家企業生産的25批次藥品不符合規定。
不合格的25批次藥品,包括注射用硫酸阿米卡星、注射用奧扎格雷鈉、黃精、元胡止痛片等。
涉事生産企業包括江蘇吳中蘇州制藥廠、湖南華納大藥廠股份有限公司、安徽國正藥業股份有限公司、海南通用康力制藥有限公司、長春人民藥業集團有限公司等14家企業。
國家藥監局表示,對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位採取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查並切實進行整改。同時,要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位生産銷售假劣藥品的違法行為立案調查,並按規定公開查處結果。
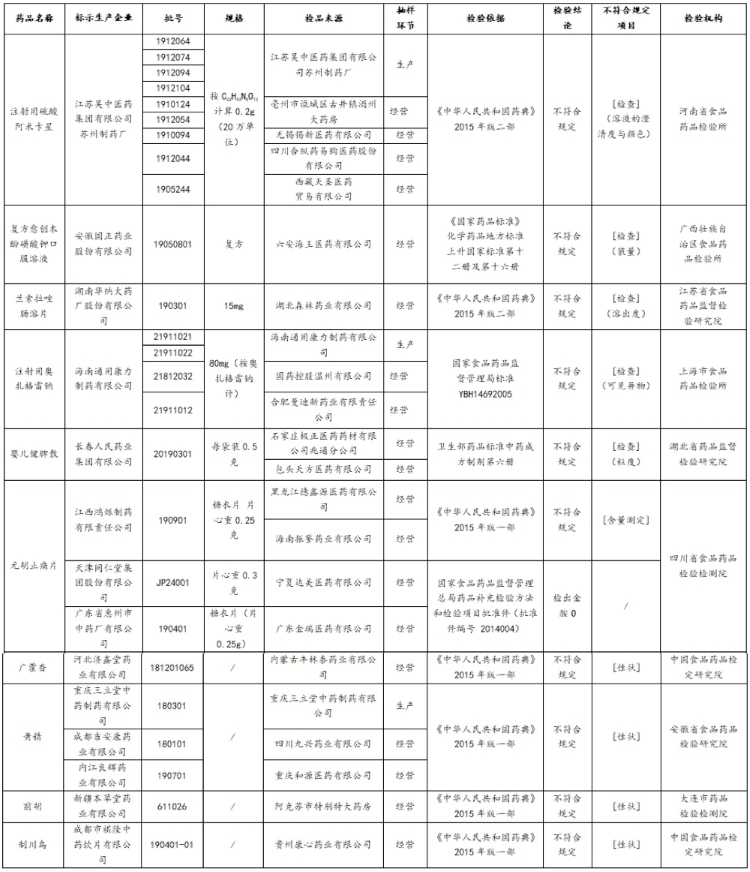
25批次不符合規定藥品名單(來源:國家藥監局)
記者注意到,此次涉事的生産企業包括江蘇吳中(600200.SH)分公司江蘇吳中蘇州制藥廠,該藥廠生産的9批次注射用硫酸阿米卡星不符合規定,不符合規定項目為溶液的澄清度與顏色。
此前,江蘇吳中曾為此連發公告。
7月3日,江蘇吳中公告稱,江蘇吳中蘇州制藥廠已暫停生産並主動召回該藥品,可能産生的損失、賠償等情況暫不明確。同時表示,問題批次産品事件發生後,公司立即啟動召回程式,發出召回通知,並要求江蘇吳中蘇州制藥廠就産品生産過程進行全面復查並及時完成整改。
此外,江蘇吳中表示,2019 年度,江蘇吳中蘇州制藥廠生産的注射用硫酸阿米卡星(0.2g)銷售收入887.13萬元,佔公司2019 年度營業收入0.42%。問題批次産品所涉品種“注射用硫酸阿米卡星(0.2g)”的銷售收入佔公司整體營業收入比重較小,對公司的正常生産經營未造成實質性影響。
7月13日,江蘇吳中公告稱,問題批次産品事件發生後,公司積極配合省級藥監部門對蘇藥廠進行調查取證、風險會商會、飛行檢查等工作。截至本公告日,江蘇吳中蘇州制藥廠已停止生産、銷售該藥品,並已啟動召回程式,發出召回通知;同時,根據對該産品已使用地區的監測,未收到相關不良反饋。
(責任編輯:牛荷)
