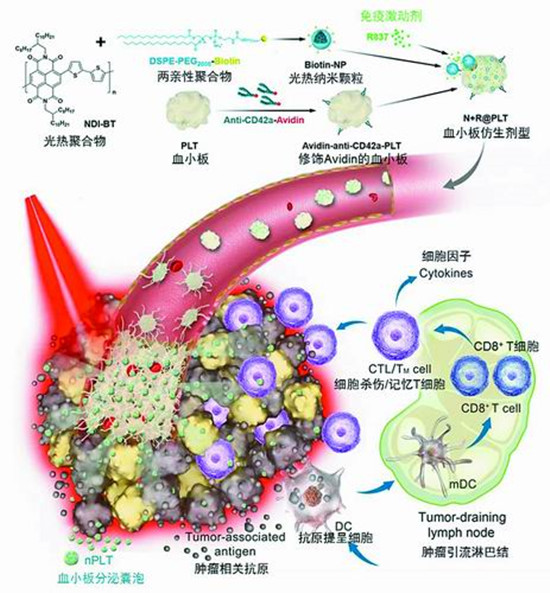
基於血小板的倣生劑型在腫瘤光熱—免疫聯合治療中的作用示意圖。研究團隊供圖
癌症,至今仍是人類難以攻克的疾病。能夠對腫瘤細胞進行“定點清除”,是全世界科學家和醫生的夢想。
3月27日,《科學進展》刊發中國科學院過程工程研究所(以下簡稱過程工程所)研究員馬光輝、魏煒與中國科學院大學化學科學學院教授田志遠等科研團隊合作完成的論文。研究人員在血小板中裝載光熱奈米顆粒與免疫激動劑,製備了新型血小板倣生劑型,在動物實驗中實現了高效的腫瘤光熱—免疫聯合治療,為腫瘤的靶向遞送和聯合治療提供了新思路。
“光熱療法”的理想與現實
在眾多腫瘤治療方法中,“光熱療法”正在受到越來越多的關注。
簡單地説,這一療法的基本原理是將光熱材料遞送至腫瘤部位,把近紅外鐳射的光能轉換為熱能,最終達到“熱”死腫瘤細胞的目的。其具有治療部位精確可控、殺傷效率高、副作用小等優點,一旦成功實現應用,將成為人類攻克腫瘤邁出的一大步。
論文共同第一作者、過程工程所呂岩霖博士向《中國科學報》介紹,目前,研究人員已經研發出用於抗腫瘤藥物遞送的多種載體。
“但是,由於腫瘤的異質性和個體差異,腫瘤部位的富集效果還有待提高。”她表示,“而且,腫瘤組織往往比較緻密,載體在腫瘤內的滲透也受到限制。”
因此,研究者普遍感到,光熱療法“理想很豐滿,現實很骨感”。目前,這一新療法仍然處於基礎研究階段,離臨床應用還有很長的距離。
利用血小板“天性”
光熱材料如何準確、高效地遞送至腫瘤部位,是解決當前困境的關鍵。自2006年起,過程工程所生化工程國家重點實驗室研究員馬光輝、魏煒發現和創制了一系列抗腫瘤遞送新劑型,嘗試了多種不同遞送策略,已取得系列進展,為解決光熱材料遞送問題提供了基礎。
在最新發表的這項研究中,科研人員提出了利用血小板作為載體的遞送策略。
研究人員介紹,血小板被稱為“血管衛士”,天然黏附受損血管並能在激活狀態下形成血栓和分泌奈米囊泡。也就是説,當血管受損時,破損處發出“信號”,血小板獲得“信號”後被激活,聚集到破損處形成血栓;激活的血小板進一步放大“信號”,“喊來”更多血小板聚集。
血小板的“天性”讓科研人員深受啟發。同時,腫瘤組織普遍存在血管缺陷的部位,正是血小板能夠“自覺前往”的地方。
他們把血小板當成“子彈殼”,把具有高光熱轉換效率的聚合物奈米顆粒作為“彈藥”裝進去。
田志遠在光熱材料的選擇、合成上作出了貢獻。“這種新型光熱奈米粒子的光熱轉換效率達到69.2%,因此低功率近紅外光照射可以産生足夠的局部熱療。”他表示。
免疫治療“加持”
除了光熱材料外,科研人員還將免疫激動劑也作為“彈藥”裝載進血小板“子彈殼”中。據了解,裝載過程操作簡單、條件溫和。
實驗中,在低功率近紅外光照射下,光熱所引起的腫瘤局部急性血管損傷激活血小板,通過層層放大“信號”的“級聯效應”在腫瘤血管處形成血栓,以此形成光熱奈米顆粒和免疫激動劑的“彈藥庫”。
而富集的血小板在上述激活狀態下還可以進一步分泌奈米級血小板囊泡。“我們觀察到奈米級血小板囊泡,將光熱奈米顆粒和免疫激動劑運送到腫瘤組織深處,擴大了‘攻擊’範圍。”魏煒表示。
在研究人員看來,這不僅有利於光熱清除更多的腫瘤細胞,而且可以增強腫瘤抗原的免疫原性,在動物實驗中完全抑制腫瘤的轉移和復發。
馬光輝指出,鋻於所裝載的奈米顆粒、藥物等具有很好的靈活性,並且血小板可從患者或者供體獲得,因此,該血小板倣生劑型在腫瘤個體化精準治療領域具有較好的臨床應用前景。
據研究人員介紹,上述成果在通過倫理審批後,已完成人源化血小板劑型的構建,並在重建人源化免疫系統的病人來源腫瘤異種移植模型上確認了顯著的療效,但仍處於動物水準的臨床前研究,實際臨床療效仍有待進一步確認。













