6月11日,廣東省藥品監督管理局發佈關於醫療器械抽查檢驗資訊的通告(2020年第6期,總第70期)。根據廣東省醫療器械品質監督抽檢工作安排,廣東省藥品監督管理局在全省範圍內組織對一次性使用麻醉穿刺包、一次性使用陰道擴張器、一次性使用真空採血管、體溫計、醫用可/非吸收縫合線、電動輪椅、人絨毛膜促性腺激素(HCG)檢測試紙等相關産品開展了專項監督抽檢,並對近兩年抽不到樣及抽檢不合格的産品和部分廣東省註冊的第二類醫療器械産品開展了跟蹤符合性監督抽檢。
廣東省醫療器械專項監督抽檢不合格産品詳細資訊表
本次監督抽檢共抽檢樣品805批次,涉及廣東省21個地市,268家生産企業(進口總代理單位),125家經營企業,243家醫療機構以及79家省外生産企業(進口總代理單位)。依據醫療器械現行的國家、行業標準和註冊産品標準/産品技術要求,對所抽樣品進行了檢驗。經檢驗,有55批次樣品被檢驗項目不符合標準要求。
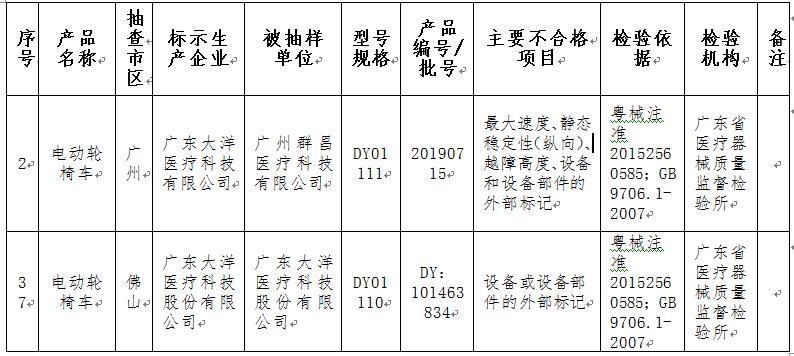
其中,標示由廣東大洋醫療科技有限公司生産的2批次電動輪椅車抽查顯示不合格。型號規格為DY01111,産品編號/批號為20190715的産品不合格項目為:最大速度、靜態穩定性(縱向)、越障高度、設備和設備部件的外部標記,檢驗依據為粵械注準20152560585;GB 9706.1-2007,被抽樣單位為廣州群昌醫療科技有限公司。型號規格為DY01110,産品編號/批號為DY:101463834的産品不合格項目為:設備或設備部件的外部標記,檢驗依據為粵械注準20152560585;GB 9706.1-2007,被抽樣單位為廣東大洋醫療科技有限公司。上述2批次産品檢驗機構為廣東省醫療器械品質監督檢驗所。
天眼查資料顯示,廣東大洋醫療科技有限公司(簡稱“大洋醫療”,870460,終止上市)的前身為佛山市大洋醫療科技有限公司,成立於2009年11月18日。2014年1月20日,公司名稱由佛山市大洋醫療科技有限公司變更為為廣東大洋醫療科技有限公司。2016年9月12日,公司名稱由廣東大洋醫療科技有限公司變更為廣東大洋醫療科技股份有限公司。廣州市達安基因科技有限公司為大洋醫療第一大股東,持股62.47%。廣州市達安基因科技有限公司為中山大學達安基因股份有限公司(簡稱“達安基因”,002030.SZ)全資子公司。
中山大學達安基因股份有限公司依託中山大學雄厚的科研平臺, 是以分子診斷技術為主導的,集臨床檢驗試劑和儀器的研發、生産、銷售以及全國連鎖醫學獨立實驗室臨床檢驗服務為一體的生物醫藥高科技企業。公司于2004年8月在深圳證券交易所掛牌上市,成為廣東省高校校辦産業中第一家上市公司。
(責任編輯:朱赫)
