中國科學家揭示外源核酸誘導的原核生物短Ago蛋白系統發揮功能的分子機理
中國網/中國發展門戶網訊 中國科學院物理研究所/北京凝聚態物理國家研究中心丁瑋團隊和朱洪濤團隊與中國醫學科學院北京協和醫學院病原生物研究所崔勝團隊合作,通過高分辨冷凍電鏡技術與自主研發的自動化結構解析策略,在數百萬計的冷凍電鏡蛋白質顆粒中,高效地篩選並重構了與原核短Ago系統相關的高解析度三維蛋白結構,並以此結構為基礎結合體外功能實驗,徹底揭示了原核短Argonaute(Ago)系統在病毒入侵前後所發生的結構變化。該研究成果北京時間2023年10月2日在國際學術期刊《自然》(Nature)線上發表。
核糖核酸誘導的轉錄後基因調控在生命個體抵禦外源入侵的過程中起到至關重要的作用。自然界中的生命體無時無刻都需要應對各種外部入侵,如細菌、病毒等。為了應對這些入侵,生命體的細胞會産生一種叫做核糖核酸的分子。這些核糖核酸分子可以通過一種叫做轉錄後基因調控的過程,對我們的基因進行調控。我們都知道基因是我們身體內部的指令,它們決定了我們長什麼樣、如何工作等等。通過轉錄後基因調控,核糖核酸分子可以激活特定的基因,使細胞産生抗體或其他防禦機制來對抗入侵者。因此,核糖核酸誘導的轉錄後基因調控在我們身體的免疫系統中起著非常重要的作用,可以幫助我們抵禦外部入侵,並保護我們的健康。
Ago蛋白便是一種能夠接受外源核酸誘導並行使防禦機制對抗入侵者的功能載體。Ago蛋白存在於古菌、細菌和真核生物等生命體中,它為非編碼小核糖核酸提供錨位點,達到降解靶基因或者抑制翻譯的目的。在生命體健康的情況下,Ago蛋白會以個體的形式在生命體內遊弋。當檢測到病毒的核酸入侵時,它們會迅速組合成功能單位,迅速分解體內的輔酶I(NAD+,即煙酰胺腺嘌呤二核苷酸)。輔酶I是負責傳遞氫離子的輔酶,參與生命體內的糖酵解、呼吸鏈等生命活動。它的大量消耗意味著被病毒感染的生命體會迅速走向死亡。而隨著宿主的死去,入侵的病毒同樣無法繼續生存,從而不可能繼續複製再去侵染其他的生命體。早在20世紀50年代,科學家們就通過間接的手段檢測到了生命體記憶體在著這種同歸於盡的自我保護行為,但受限于當時的軟硬體水準,這一過程的實現機制,一直是困擾科學家們的謎題。
該研究通過高分辨冷凍電鏡技術與自主研發的自動化結構解析策略,在數百萬計的冷凍電鏡蛋白質顆粒中,高效地篩選並重構了與原核短Ago系統相關的高解析度三維蛋白結構,並以此結構為基礎結合體外功能實驗,徹底揭示了原核短Ago系統在病毒入侵前後所發生的結構變化【圖1b-f】。
當病毒入侵發生時,原核短Ago系統功能單元單體會從入侵基因的轉錄組中獲得引導核糖核酸片段。該引導核糖核酸片段會與原核短Ago系統結合,並進一步通過鹼基配對識別與引導核糖核酸序列互補的目標脫氧核糖核酸 【圖1b-c】。在此過程中,引導核糖核酸可能會從它在MID結構域中的結合位點上解離,以便引導核糖核酸與靶向脫氧核糖核酸的雜交雙鏈的形成。雜交雙鏈的形成會導致原核短Ago系統的構象發生變化,並通過MID結構域形成二聚體【圖1c】。而在形成二聚體的過程中,一個功能單元的TIR結構域會發生翻轉並與另一個功能單元的TIR相互作用,使得兩個TIR結構域以頭尾相接的形式組織在一起,並在作用界面上形成一個完整的降解輔酶I的活性位點【圖1d】。最後,兩個二聚體會進一步通過它們的TIR結構域形成一個四聚體【圖1e】。四聚體形式的組裝體能夠起到降解輔酶I的作用。而生命體內輔酶I的快速耗盡,將導致生命體本身的死亡,從而阻止了入侵病毒的進一步擴增。這項工作對於深入理解原核短Ago系統如何發揮功能提供了重要的結構基礎,同時也最終揭示了原核短Ago中降解輔酶I的激活機制以及導致細菌等生命體死亡的分子機理【圖2】,為後續對人體免疫系統的研究以及相關藥物的研發提供了結構基礎和理論指導。
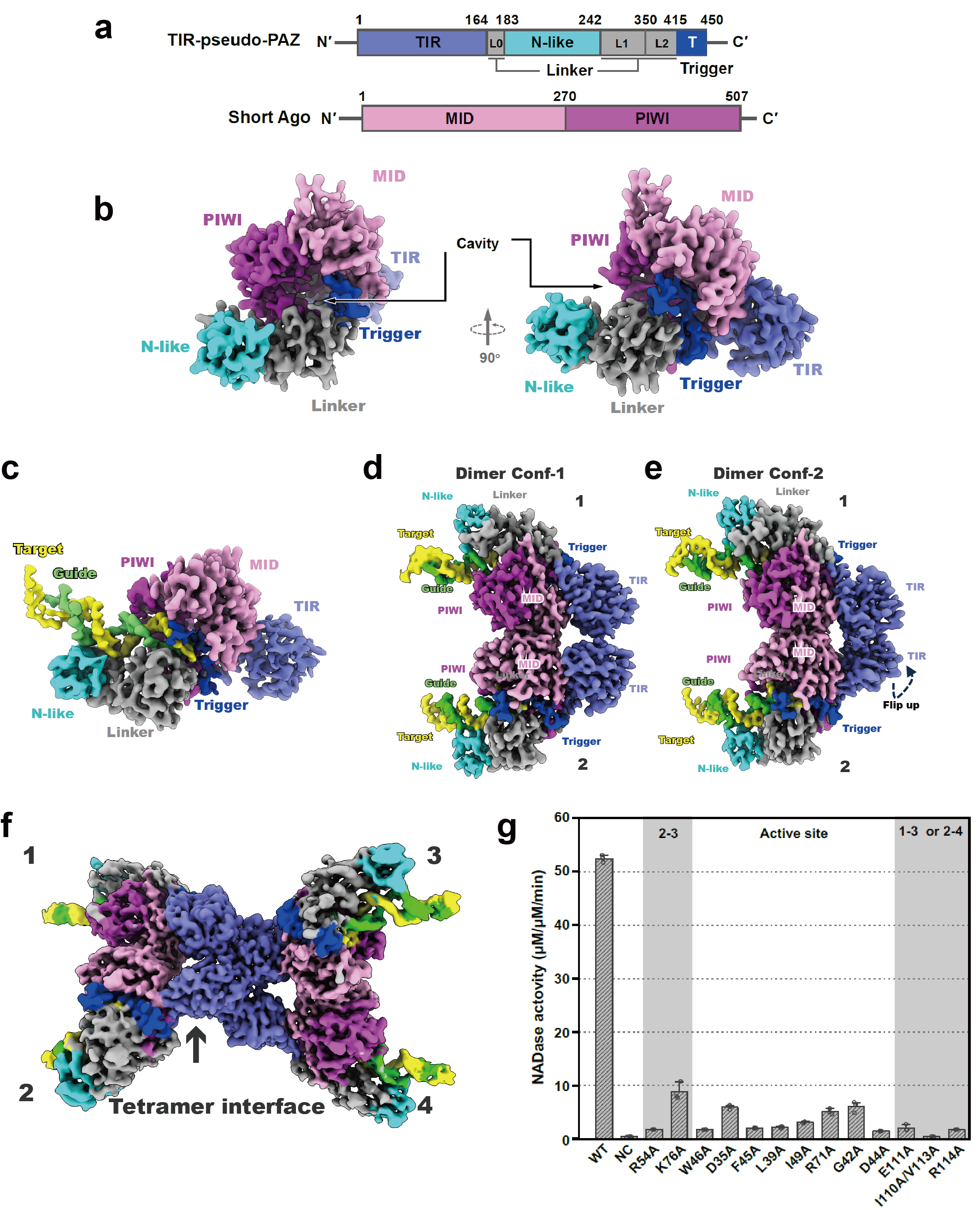
【圖1】原核短Ago的三維高分辨結構
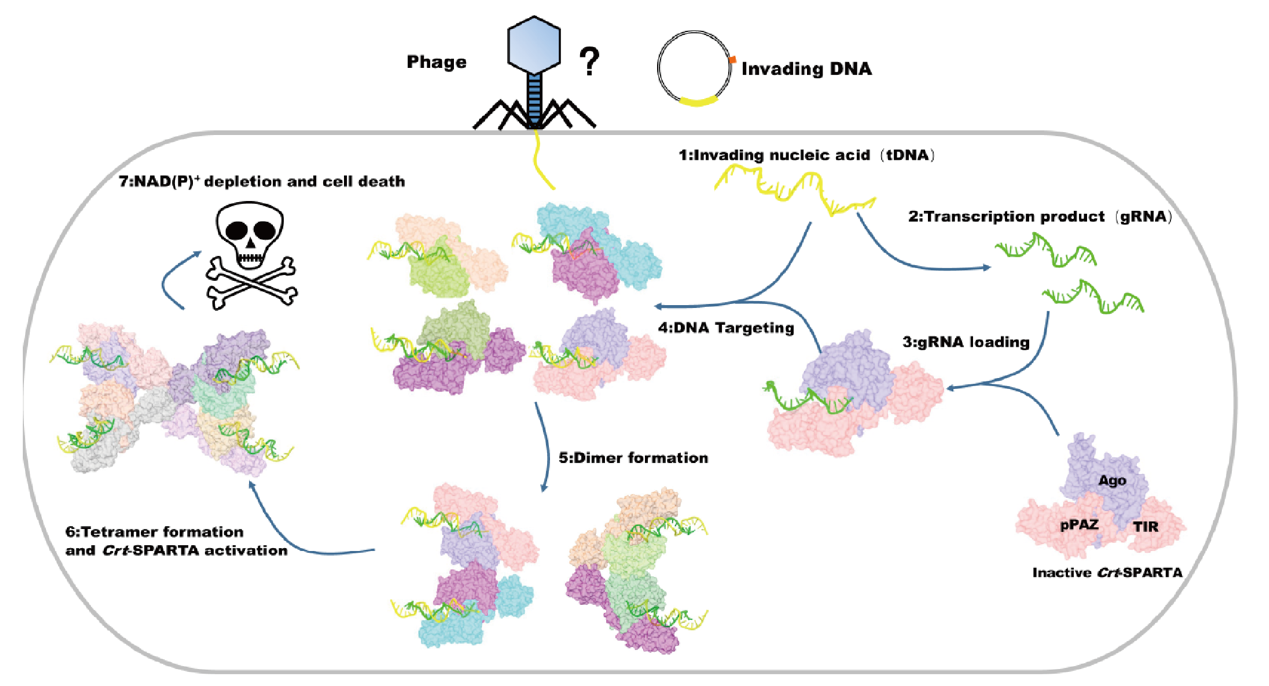
【圖2】原核短Ago中輔酶I的激活機制以及導致細菌死亡的分子機理












