Nature子刊全新成果:開發出一種新的精確靶向細胞外囊泡mRNA治療方法
近日,由深圳灣實驗室腫瘤研究所/北京大學深圳研究生院共同通訊作者Andrew Lee教授、醫學博士與俄亥俄州立大學、思珀生物、中國台灣陽明交通大學、中國台灣成功大學醫院和德克薩斯大學安德森癌症中心的聯合合作在Nature Communications發表了《Dual targeted extracellular vesicles regulate oncogenic genes in advanced pancreatic cancer》一文。

作為2020年和2023年Nature Biomedical Engineering論文對細胞衍生外囊泡mRNA療法(EV mRNA)和細胞奈米穿孔(CNP)進行探索的系列論文,作者重點報道了一種攜帶高負荷治療性mRNA的雙靶向細胞外囊泡(dtEV) 並且可以與siRNA和化療藥物聯合使用。作者證明,這種精確靶向系統可以在體內治療胰腺導管腺癌(PDAC),包括PANC-1和患者來源的異種移植腫瘤和小鼠轉移瘤,延長動物生存期。在本文中,研究團隊提出了一種臨床可擴展的方法來生産大量的細胞外囊泡,用於向大型實體瘤遞送多基因貨物。
在這之前,將多種遺傳介質精確地輸送到如胰腺導管腺癌(PDAC)這種晚期腫瘤是一個重大挑戰,傳統技術脂質奈米粒(LNP)尚不能實現精確靶向,它不僅在靜脈給藥時進入肝臟,而且脂質奈米粒(LNP) mRNA在靜脈注射遞送時靶向肝外的位點也存在很大的障礙。
該研究團隊開發出一種新的精確靶向細胞外囊泡mRNA治療方法,即利用一種新的雙靶向蛋白和抗體系統,它能夠將mRNA精確定位並傳送到肝臟外的位點,如胰腺導管腺癌(PDAC)。這不僅優於脂質奈米粒(LNP),並且還允許靶向遞送多種藥物,如siRNA,化療藥,mRNA等滲透腫瘤組織;脂質奈米粒(LNP)難以實現如上功能充分體現出雙靶向蛋白和抗體系統的巨大應用潛力。
為驗證雙靶向系統肝外精確遞送的準確性,該團隊展示了mRNA與siRNA和化療聯合靶向遞送到胰腺導管腺癌(PDAC)。研究中報道了一種易於擴展的雙靶向治療性EVs(dtEVs),該EVs含有高拷貝數的TP53 mRNA或siKRASG12D,可以有效抑制大型實體PDAC腫瘤。並通過蛋白工程設計,將dtEV表面的CD64 (fc-受體1)蛋白的N端與CKAAKNK(CK)組織歸巢肽連接,同時CD64也可以連接人類單株抗體 (hmAb),實現了雙重靶向胰腺腫瘤組織。
最後的細胞運輸結果表明,雙重靶向促進了受體介導的組織滲透、腫瘤細胞攝取和細胞溶膠RNA釋放。該研究團隊展示了一種簡單、低成本的方法來生産大量的靶向EVs,攜帶高負荷的基因載物,可以有效地治療動物模型中的晚期癌症。
主要實驗數據如圖所示:
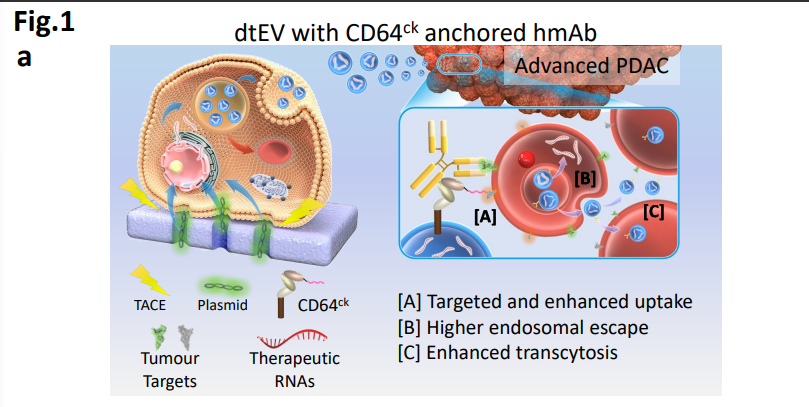
圖1a: dtEV與CD64ck錨定人類單株抗體(hmAb)示意圖
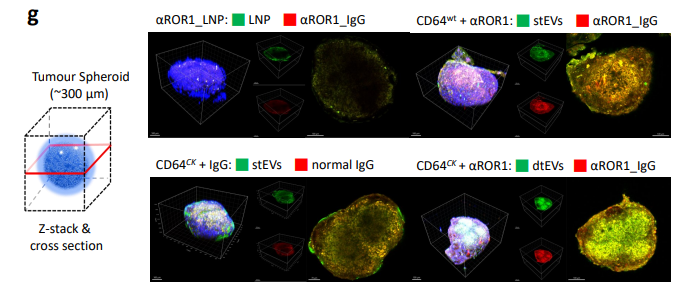
圖3g. 經EV給藥後的靶向細胞(例如腫瘤細胞球)對EV的攝取與組織滲透有所改善,遠優於LNP;因為腫瘤細胞球對LNP的攝取與組織滲透程度很差。
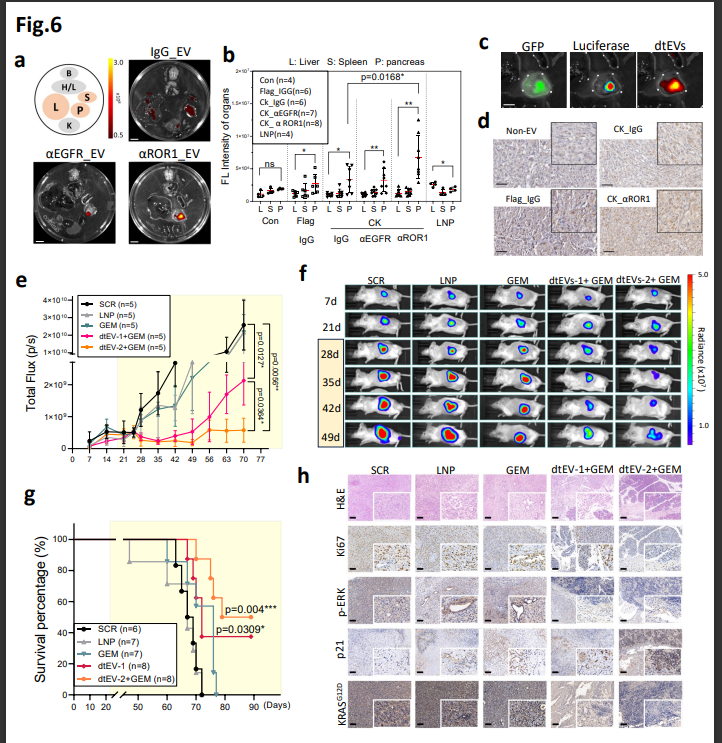
圖6. 結果表明: 與LNP相比,dtEV mRNA/siRNA對PDAC的精確靶向和治療效果有所提高,LNP無法實現對PDAC的精確靶向或治療有效載荷的傳遞。
實驗中,這種雙靶向方法顯著改善了腫瘤靶向、腫瘤組織穿透和細胞攝取。在該相關研究團隊看來,除了傳統的化療藥物外,基於EV的基因療法還具有與其他癌症治療方式結合的潛力。通過細胞奈米穿孔(CNP)産生的靶向EV可用於傳遞來自不同細胞來源的特定編碼和非編碼基因,這在神經退行性疾病、自身免疫性疾病等多種疾病中具有潛在的應用前景。

















