當前位置: 健康中國> >
國家藥監局通報:九江高科等企業生産的貼敷類醫療器械不合規
發佈時間: 2023-08-03 09:55:20 | 來源: 中國新聞網 | 責任編輯: 張豐
國家藥監局網站日前發佈《關於發佈國家醫療器械監督抽檢結果的通告》。廣東精美醫療科技有限公司、九江高科制藥技術有限公司、鄭州市中原福力工貿有限公司、南京賽爾金生物醫學有限公司等9家企業生産的12批(臺)醫療器械不符合規定。
具體情況通告如下:
(一)牙科低壓電動馬達1台:廣東精美醫療科技有限公司生産,涉及漏電流和患者輔助電流(工作溫度下)、空載轉速不符合標準規定。
(二)立式壓力蒸汽滅菌器1台:合肥華泰醫療設備有限公司生産,涉及“可觸及零部件的允許限值正常條件下的值”、單一故障條件下的限值(斷地)不符合標準規定。
(三)電動吸引器1台:蘇州貝茵科技股份有限公司生産,涉及“由網電源驅動、可移動的高負壓/高流量設備”不符合標準規定。
(四)貼敷類醫療器械(遠紅外治療貼、磁療貼、穴位磁療貼)6批次:分別為九江高科制藥技術有限公司、鄭州市中原福力工貿有限公司、烏蘭察布市喬氏偉業醫療器械有限公司、湖南德禧醫療科技有限公司、重慶正仁醫療器械有限公司生産,涉及檢出“按照補充檢驗方法要求不得檢出的相關藥物成分”。
(五)人體血液及血液成分袋式塑膠容器(血袋)3批次:南京賽爾金生物醫學有限公司生産,涉及血袋輸血插口不符合標準規定。
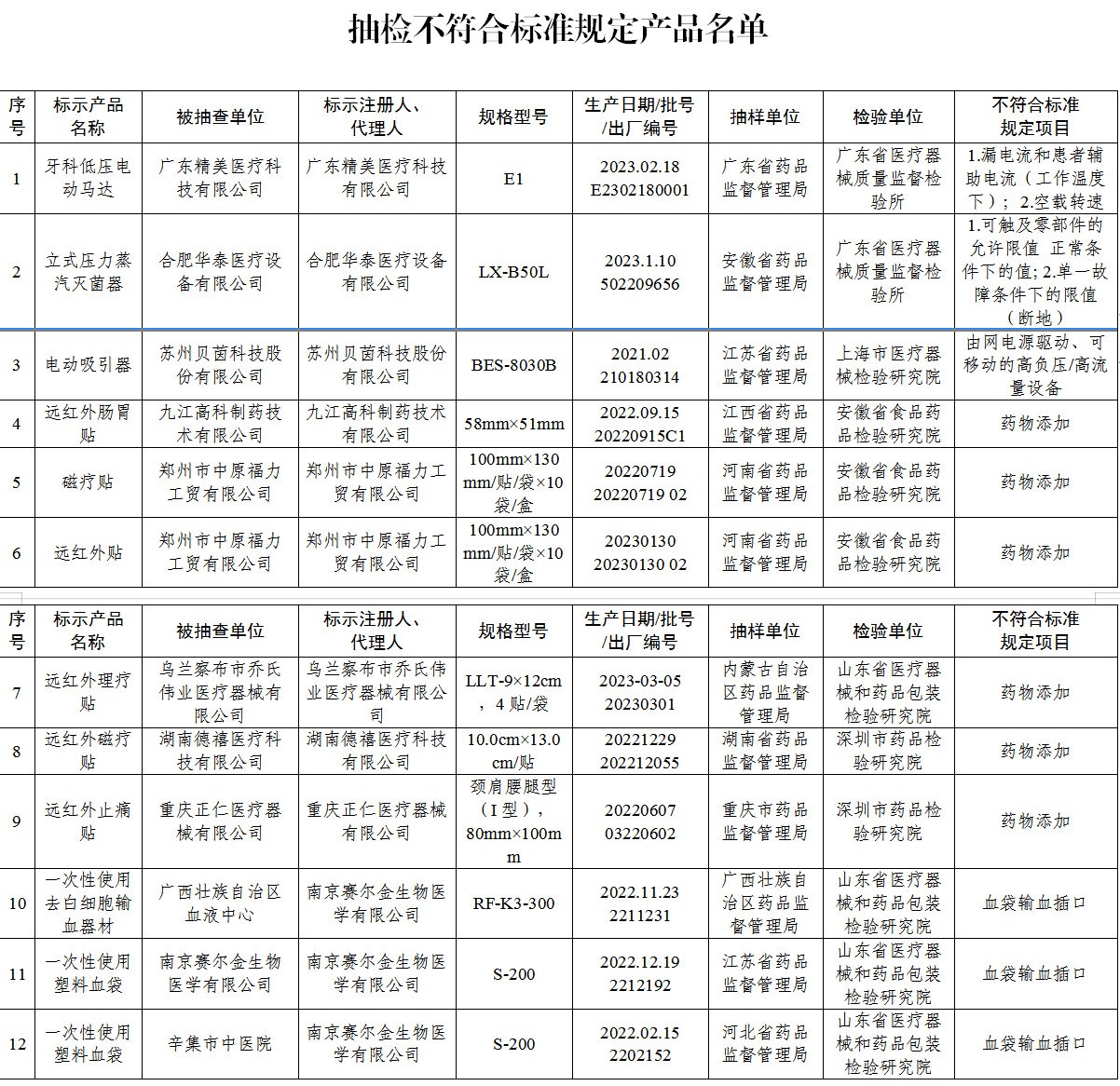
抽檢不符合標準規定産品名單 截圖來源:國家藥監局官網
《通告》提到,對抽檢中發現的上述不符合標準規定産品,國家藥品監督管理局已要求企業所在地省級藥品監督管理部門按照《醫療器械監督管理條例》《醫療械生産監督管理辦法》和《醫療器械召回管理辦法》等要求,及時作出行政處理決定並向社會公佈。省級藥品監督管理部門要督促企業對抽檢不符合標準規定的産品進行風險評估,根據醫療器械缺陷的嚴重程度確定召回級別,主動召回産品並公開召回資訊;督促企業儘快查明産品不合格原因,制定整改措施並按期整改到位。
延伸閱讀
