國家藥監局公佈49批次不符合規定藥品
發佈時間: 2023-07-18 16:30:41 | 來源: 新華網 | 責任編輯: 張豐
經甘肅省藥品檢驗研究院等10家藥品檢驗機構檢驗,標示為北京朗迪制藥有限公司等16家企業生産的碳酸鈣D3顆粒等49批次藥品不符合規定。現將相關情況通告如下:
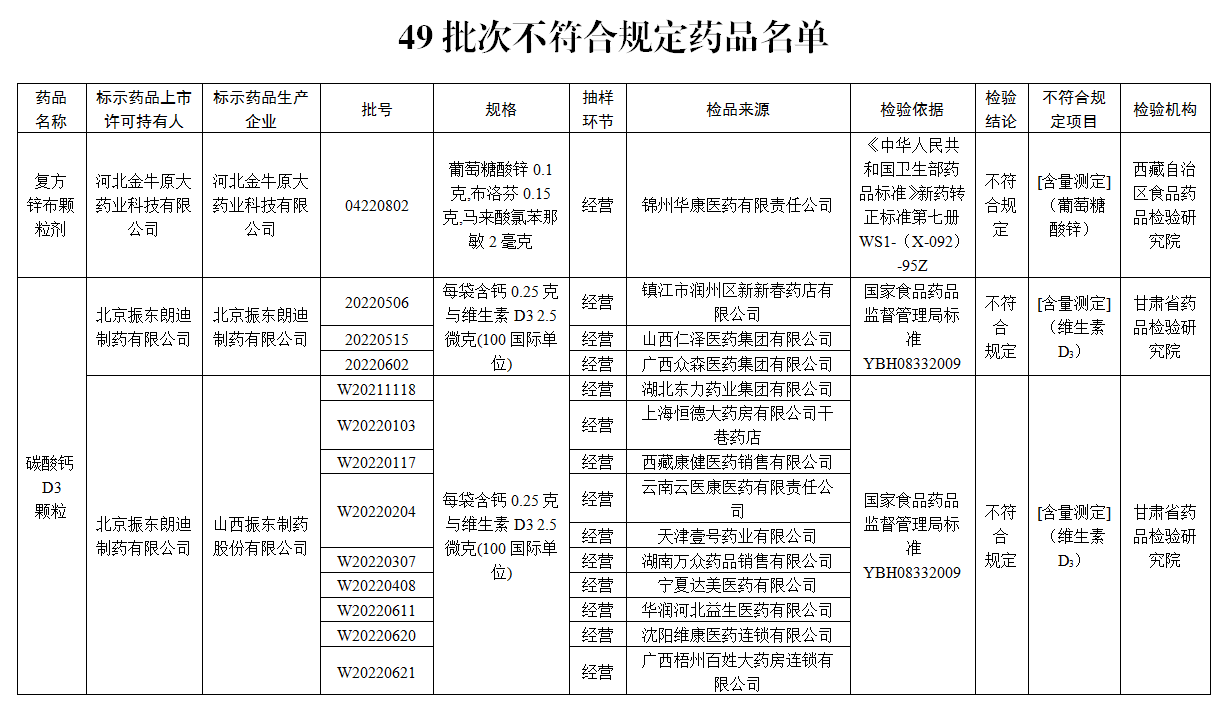
一、經西藏自治區食品藥品檢驗研究院檢驗,標示為河北金牛原大藥業科技有限公司生産的1批次復方鋅布顆粒劑不符合規定,不符合規定項目為含量測定。
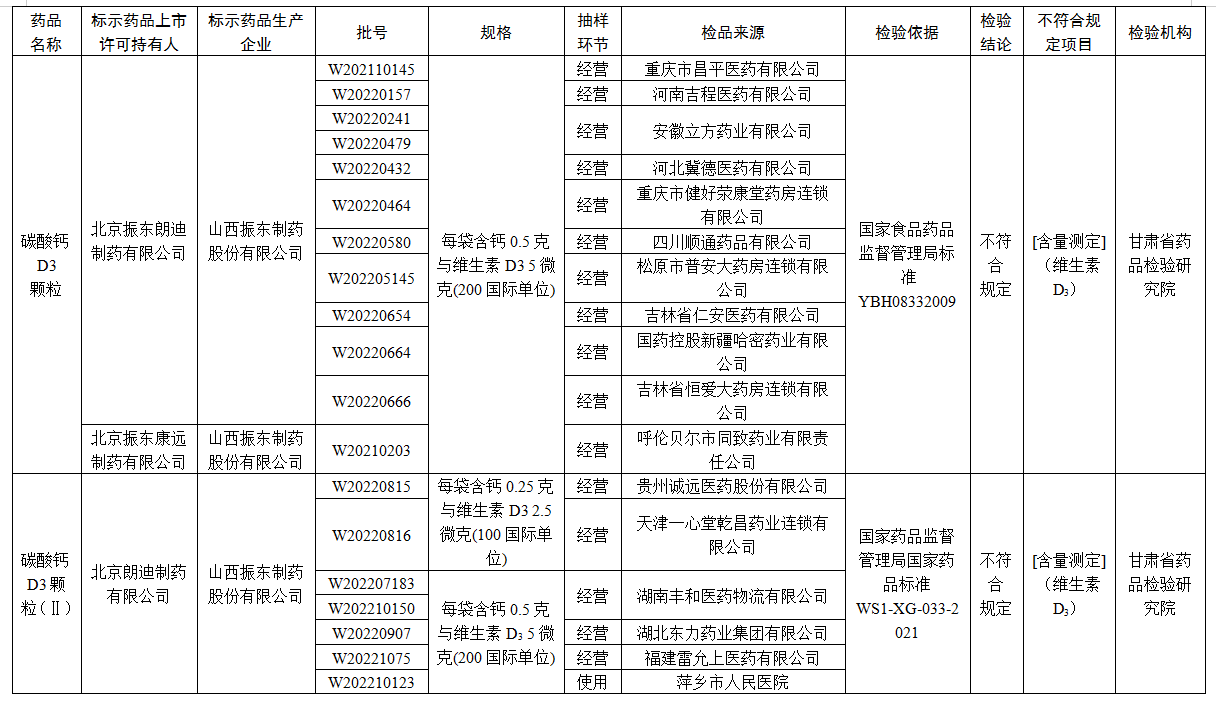
經甘肅省藥品檢驗研究院檢驗,標示為北京振東朗迪制藥有限公司、北京振東朗迪制藥有限公司委託山西振東制藥股份有限公司、北京振東康遠制藥有限公司委託山西振東制藥股份有限公司生産的24批次碳酸鈣D3顆粒不符合規定,不符合規定項目均為含量測定。
經甘肅省藥品檢驗研究院檢驗,標示為北京朗迪制藥有限公司委託山西振東制藥股份有限公司生産的7批次碳酸鈣D3顆粒(Ⅱ)不符合規定,不符合規定項目均為含量測定。
經甘肅省藥品檢驗研究院檢驗,標示為北京朗迪制藥有限公司委託山西振東制藥股份有限公司生産的1批次碳酸鈣D3片(Ⅱ)不符合規定,不符合規定項目為含量測定。
經廣東省藥品檢驗所檢驗,標示為長春新安藥業有限公司生産的1批次雙氯芬酸鈉腸溶片不符合規定,不符合規定項目為緩衝液中溶出量。
經江蘇省食品藥品監督檢驗研究院檢驗,標示為山東益康藥業股份有限公司生産的1批次左卡尼汀口服溶液不符合規定,不符合規定項目為苯甲酸鈉。
經遼寧省藥品檢驗檢測院檢驗,標示為安徽永生堂藥業有限責任公司生産的1批次傷科跌打片不符合規定,不符合規定項目為重量差異。
經山東省食品藥品檢驗研究院檢驗,標示為湖南金壽制藥有限公司生産的2批次麝香鎮痛膏不符合規定,不符合規定項目為黏附力測定。
經重慶市食品藥品檢驗檢測研究院檢驗,標示為禹州市天源藥業有限公司生産的3批次丹參配方顆粒不符合規定,不符合規定項目為含量測定。
經寧夏回族自治區藥品檢驗研究院檢驗,標示為瀘州百草堂中藥飲片有限公司、四川自強中藥有限公司、江西和碩藥業有限公司生産的3批次地骨皮不符合規定,不符合規定項目包括總灰分、水分。
經安徽省食品藥品檢驗研究院檢驗,標示為江西信健藥業有限公司生産的1批次防己不符合規定,不符合規定項目為水分。
經中國食品藥品檢定研究院檢驗,標示為安國潤德藥業有限公司、河北潤華藥業有限公司、九洲恒源(安國)藥業有限公司、四川同創康能藥業有限公司生産的4批次女貞子不符合規定,不符合規定項目為水分。
二、對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位採取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查並切實進行整改。
三、國家藥監局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位存在的涉嫌違法行為立案調查,並按規定公開查處結果。