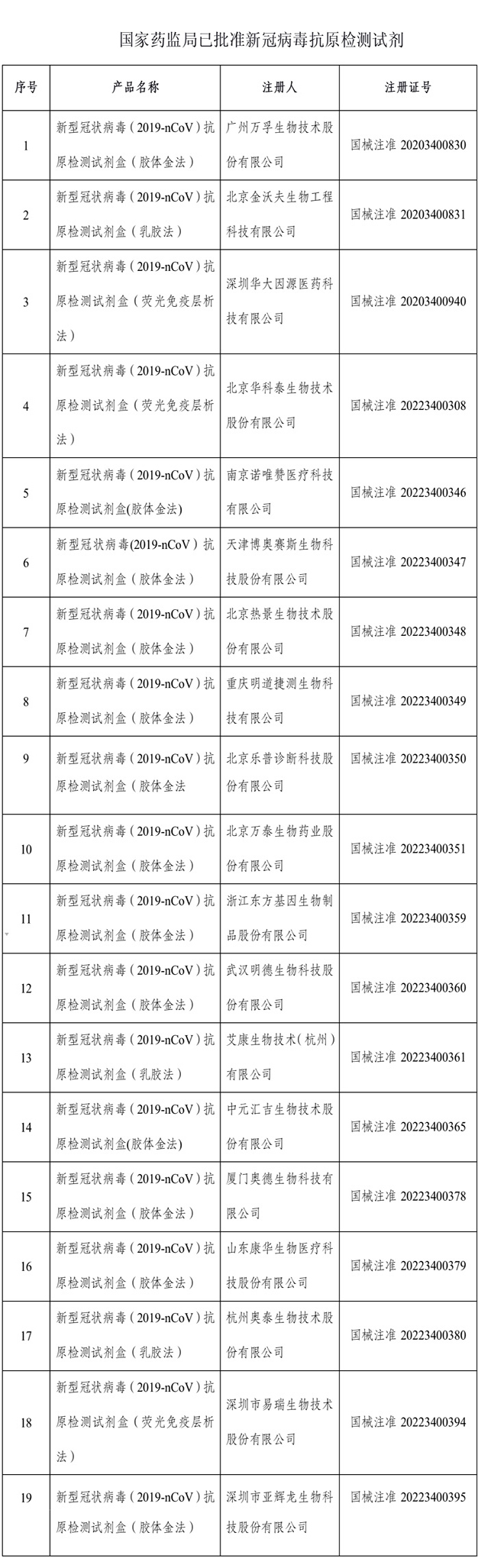
國家藥監局已批准19個新冠病毒抗原檢測試劑
發佈時間: 2022-03-25 07:29 | 來源: 人民網 | 作者: 孫紅麗 | 責任編輯: 李培剛
據國家藥監局官網消息,3月23日,經國家藥監局審查,批准2個新冠病毒抗原檢測試劑産品。截至3月23日,國家藥監局已批准19個新冠病毒抗原檢測試劑産品。
國家藥監局表示,新冠病毒抗原檢測試劑適用於《新冠病毒抗原檢測應用方案(試行)》(聯防聯控機制綜發〔2022〕21號)規定的人群。藥品監督管理部門將加強相關産品上市後監管,保護患者用械安全。
資料顯示,3月12日,國家藥監局發佈通告,批准南京諾唯讚、北京金沃夫、深圳華大因源、廣州萬孚生物、北京華科泰生物的新冠病毒抗原産品自測應用申請變更。
3月13日,國家藥監局批准5家新冠病毒抗原産品的註冊申請,分別為萬泰生物、熱景生物、天津博奧賽斯生物、重慶明道捷測生物和北京樂普診斷。
3月15日,國家藥監局批准2家新冠病毒抗原産品的註冊申請,分別為浙江東方生物、武漢明德生物。
3月16日,國家藥監局批准艾康生物技術(杭州)有限公司的新冠病毒抗原産品的註冊申請。
3月17日,國家藥監局批准中元匯吉生物技術股份有限公司的新冠病毒抗原産品的註冊申請。
3月18日,國家藥監局批准3家新冠病毒抗原産品的註冊申請,分別為廈門奧德生物、山東康華生物、杭州奧泰生物。
國家藥監局官網截圖




